リタリン錠「チバ」/
1%リタリン散「チバ」
作成又は改訂年月
-
**
2007年10月改訂
(第9版)
-
*
2007年9月改訂
日本標準商品分類番号
-
871179
日本標準商品分類番号等
- 再評価結果公表年月(最新)
-
1998年3月
薬効分類名
- 中枢神経興奮剤
承認等
- 販売名
-
リタリン錠「チバ」
販売名コード
-
1179009F1027
承認・許可番号
- 承認番号
-
13600AZZ00111000
- 商標名
-
Ritalin
薬価基準収載年月
-
1961年11月
販売開始年月
-
1958年11月
貯法・使用期限等
- 貯法
- 防湿、室温保存
- 使用期限
- 包装に表示の使用期限を参照のこと
使用期限内であっても、開封後はなるべく速やかに使用すること
規制区分
- 劇薬
- 向精神薬
- 指定医薬品
- 処方せん医薬品
- (注意-医師等の処方せんにより使用すること)
組成
- 成分・含量
- 1錠中塩酸メチルフェニデート 10mg
- 添加物
- 乳糖、第三リン酸カルシウム、トウモロコシデンプン、ヒドロキシプロピルセルロース、リン酸二水素カルシウム、ゼラチン、タルク、ステアリン酸マグネシウム
性状
- 性状
- 白色の裸錠
- 外形
-

- 識別コード
- CG 202
- 大きさ(約)
- 直径:7.0mm 厚さ:2.6mm 質量:0.14g
- 販売名
-
1%リタリン散「チバ」
販売名コード
-
1179009B1025
承認・許可番号
- 承認番号
-
13600AZZ00110000
- 商標名
-
Ritalin
薬価基準収載年月
-
1961年11月
販売開始年月
-
1958年11月
貯法・使用期限等
- 貯法
- 室温保存
- 使用期限
- 包装に表示の使用期限を参照のこと
使用期限内であっても、開封後はなるべく速やかに使用すること
規制区分
- 劇薬
- 向精神薬
- 指定医薬品
- 処方せん医薬品
- (注意-医師等の処方せんにより使用すること)
組成
- 成分・含量
- 1g中塩酸メチルフェニデート 10mg
- 添加物
- 乳糖
性状
- 性状
- 白色の散剤
一般的名称
- 塩酸メチルフェニデート製剤
警告
- **本剤の投与は、ナルコレプシーの診断、治療に精通し、薬物依存を含む本剤のリスク等についても十分に管理できる医師・医療機関・管理薬剤師のいる薬局のもとでのみ行うとともに、それら薬局においては、調剤前に当該医師・医療機関を確認した上で調剤を行うこと。
|
禁忌
(次の患者には投与しないこと)
- 1.
- 過度の不安、緊張、興奮性のある患者〔中枢神経刺激作用により症状を悪化させることがある。〕
- 2.
- 緑内障のある患者〔眼圧を上昇させるおそれがある。〕
- 3.
- 甲状腺機能亢進のある患者〔循環器系に影響を及ぼすことがある。〕
- 4.
- 不整頻拍、狭心症のある患者〔症状が悪化するおそれがある。〕
- 5.
- 本剤の成分に対し過敏症の既往歴のある患者
- 6.
- 運動性チック、Tourette症候群の患者又はその既往歴・家族歴のある患者〔症状を悪化又は誘発させることがある。〕
- 7.
- 重症うつ病の患者〔抑うつ症状が悪化するおそれがある。〕
- 8.
- *褐色細胞腫のある患者〔血圧を上昇させるおそれがある。〕
- 9.
- **モノアミンオキシダーゼ(MAO)阻害剤を投与中又は投与中止後14日以内の患者(「相互作用」の項参照)
|
原則禁忌
(次の患者には投与しないことを原則とするが、特に必要とする場合には慎重に投与すること)
- 6歳未満の幼児(「小児等への投与」の項参照)
|
効能又は効果
- **ナルコレプシー
用法及び用量
- **ナルコレプシーには、塩酸メチルフェニデートとして、通常成人1日20~60mgを1~2回に分割経口投与する。なお、年齢、症状により適宜増減する。
使用上の注意
慎重投与(次の患者には慎重に投与すること)
- 1.
- てんかん又はその既往歴のある患者〔痙攣閾値を低下させ、発作を誘発させるおそれがある。〕
- 2.
- **高血圧の患者、心不全、心筋梗塞を起こしたことのある患者〔血圧又は心拍数を上昇させるおそれがある。〕
- 3.
- *脳血管障害(脳動脈瘤、血管炎、脳卒中等)のある患者又はその既往歴のある患者〔これらの症状を悪化又は再発させることがある。〕
- 4.
- **下記の精神系疾患のある患者〔行動障害、思考障害又は躁病エピソードの症状が悪化するおそれがある。〕
統合失調症、精神病性障害、双極性障害
- 5.
- **薬物依存又はアルコール中毒等の既往歴のある患者〔慢性的乱用により過度の耐性及び様々な程度の異常行動を伴う精神的依存を生じる可能性がある。〕
- 6.
- **心臓に構造的異常又は他の重篤な問題のある患者〔因果関係は確立していないが、中枢神経刺激作用を有する薬剤の投与による突然死の報告がある。〕
重要な基本的注意
- 1.
- **本剤を投与する医師又は医療従事者は、投与前に患者又は家族等に対して、本剤の治療上の位置づけ、依存性等を含む本剤のリスクについて、十分な情報を提供するとともに、適切な使用法について指導すること。
- 2.
- **小児に中枢神経刺激剤を長期投与した場合に体重増加の抑制、成長遅延が報告されている。中枢神経刺激剤の小児の成長への影響は確立していないが、本剤の投与が長期にわたる場合には患児の成長に注意し、身長や体重の増加が思わしくない時は投与を中断すること。(「小児等への投与」の項参照)
- 3.
- **本剤を長期間投与する場合には、定期的に血液学的検査を行うことが望ましい。
- 4.
- **患者の心疾患に関する病歴、突然死や重篤な心疾患に関する家族歴等から、心臓に重篤ではないが異常が認められる、若しくはその可能性が示唆される患者に対して本剤の投与を検討する場合には、投与開始前に心電図検査等により心血管系の状態を評価すること。
- 5.
- **心血管系に対する影響を観察するため、本剤の投与期間中は、定期的に心拍数(脈拍数)及び血圧を測定すること。
- 6.
- **視覚障害の症状(視調節障害、霧視)が報告されている。視覚障害が認められた場合には、眼の検査を実施し、必要に応じて投与を中断又は中止すること。
- 7.
- **通常量の本剤を服用していた精神病性障害や躁病の既往がない患者において、幻覚等の精神病性又は躁病の症状が報告されている。このような症状の発現を認めたら、本剤との関連の可能性を考慮すること。投与中止が適切な場合もある。
- 8.
- 覚醒効果があるので、不眠に注意し、夕刻以後の服薬は原則として避けさせること。
- 9.
- 本剤投与中の患者には、自動車の運転等危険を伴う機械の操作には従事させないように注意すること。
相互作用
併用禁忌
(併用しないこと)
- 薬剤名等
-
**MAO阻害剤(セレギリン(エフピー))
- 臨床症状・措置方法
-
MAO阻害剤の作用を増強させ、高血圧が起こることがある。
- 機序・危険因子
-
本剤は交感神経刺激作用を有するため。
|
併用注意
(併用に注意すること)
- 1.
薬剤名等
昇圧剤
- 臨床症状・措置方法
-
昇圧作用を増強させることがある。
- 機序・危険因子
-
本剤は交感神経刺激作用を有するため。
- 2.
薬剤名等
**クマリン系抗凝血剤(ワルファリン)
- 臨床症状・措置方法
-
クマリン系抗凝血剤の作用が増強されることがある。
- 機序・危険因子
-
クマリン系抗凝血剤の半減期を延長させる。
- 3.
薬剤名等
抗痙攣剤(フェノバルビタール、フェニトイン、プリミドン)
- 臨床症状・措置方法
-
抗痙攣剤の作用が増強されることがある。
- 機序・危険因子
-
本剤はこれらの薬剤の代謝を阻害すると考えられる。
- 4.
薬剤名等
**三環系抗うつ剤(イミプラミン等)
選択的セロトニン再取り込み阻害剤(フルボキサミン、パロキセチン、セルトラリン)
- 臨床症状・措置方法
-
三環系抗うつ剤、選択的セロトニン再取り込み阻害剤の作用が増強されることがある。
- 機序・危険因子
-
本剤はこれらの薬剤の代謝を阻害すると考えられる。
- 5.
薬剤名等
**クロニジン
- 臨床症状・措置方法
-
本剤との併用により、突然死の報告がある。(「その他の注意」の項参照)
- 機序・危険因子
-
機序は不明である。
- 6.
薬剤名等
アルコール
- 臨床症状・措置方法
-
精神神経系の副作用が増強されることがある。
- 機序・危険因子
-
アルコールは本剤の精神神経系の作用を増強させる。
副作用
- 承認時まで及び承認後の副作用調査例数の累計325例中201例(61.9%)に副作用が認められ、主な症状としては口渇(32.9%)、頭痛(14.8%)、発汗(24.3%)、食欲減退(16.9%)等がみられている。(本剤はうつ病については副作用頻度が明確となる調査を実施していないため、ナルコレプシーについて行われた調査を集計した。)
重大な副作用
1.
剥脱性皮膚炎(頻度不明)
症状があらわれた場合は投与を中止し、適切な処置を行うこと。
2.
狭心症(頻度不明)
症状があらわれた場合には投与を中止し、適切な処置を行うこと。
3.
悪性症候群(Syndrome malin)(頻度不明)
発熱、高度の筋硬直、CK(CPK)上昇等があらわれることがあるので、このような場合には体冷却、水分補給等の適切な処置を行うこと。
4.
*脳血管障害(血管炎、脳梗塞、脳出血、脳卒中)(頻度不明)
症状があらわれた場合には投与を中止し、適切な処置を行うこと。
その他の副作用
- 1.
過敏症注1)
- (頻度不明)
- 紅斑等
- 2.
過敏症注1)
- (5%未満)
- 発疹、関節痛
- 3.
眼
- (頻度不明)
- 視調節障害、霧視
- 4.
精神神経系
- (頻度不明)
- 興奮、チック、舞踏病様症状、Tourette症候群、ジスキネジア等
痙攣、常同運動、運動亢進、中毒性精神障害注2)
作用消失後の眠気、抑制、不機嫌・不快感、けん怠感、易疲労感
- 5.
精神神経系
- (5%以上)
- 頭痛・頭重、注意集中困難、神経過敏、不眠、眠気
- 6.
精神神経系
- (5%未満)
- 不安、焦燥、易怒・攻撃的、行為心迫、うつ状態、幻覚、妄想、眩暈、振戦
- 7.
消化器
- (5%以上)
- 口渇、食欲不振、胃部不快感、便秘
- 8.
消化器
- (5%未満)
- 悪心・嘔吐、下痢、口内炎等
- 9.
循環器
- (5%以上)
- 心悸亢進、不整脈
- 10.
循環器
- (5%未満)
- 頻脈、血圧上昇、血圧下降等、胸部圧迫感
- 11.
血液
- (頻度不明)
- 血小板減少性紫斑、白血球減少、血小板減少、貧血
- 12.
肝臓
- (頻度不明)
- 黄疸、肝機能検査値の異常(AST(GOT)・ALT(GPT)・Al-P上昇等)
- 13.
その他
- (頻度不明)
- 発熱、体重減少、頻尿、脱毛等
- 14.
その他
- (5%以上)
- 排尿障害、性欲減退、発汗、筋緊張
- 注1)このような場合には投与を中止すること。
- 注2)観察を十分に行い、このような場合には中枢抑制剤(睡眠薬、抗不安薬、抗精神病薬)の投与等適切な処置を行うこと。
高齢者への投与
- 一般に高齢者では生理機能が低下しているので、減量するなど注意すること。
妊婦、産婦、授乳婦等への投与
- 1.
- 妊婦又は妊娠している可能性のある婦人には投与しないことが望ましい。〔動物実験(ウサギ)において大量投与(200mg/kg/日)により催奇形性(二分脊椎)が報告されている。〕
- 2.
- **授乳婦に投与する場合には、授乳を中止させること。〔動物実験(ラット)において、乳汁中への移行が認められている。〕
小児等への投与
- 1.
- 6歳未満の幼児には投与しないこと。〔安全性が確立していない。〕
- 2.
- **小児に長期投与した場合、体重増加の抑制、成長遅延が報告されている。(「重要な基本的注意」の項参照)
過量投与
- 徴候、症状1)
- 主に中枢神経系の過剰刺激及び過度の交感神経興奮に起因する次の諸症状
嘔吐、激越、振戦、反射亢進、筋攣縮、痙攣(昏睡を続発することがある)、多幸感、錯乱、幻覚、せん妄、発汗、潮紅、頭痛、高熱、頻脈、心悸亢進、不整脈、高血圧、散瞳、粘膜乾燥
- **処置1)
- 症状に応じた支持療法を行う。自己損傷の防止、過刺激症状をさらに悪化させる外部刺激の排除に留意。
徴候、症状がそれほど重篤でなく、患者に意識がある場合には催吐あるいは胃洗浄によって胃内容物を除去する。重篤な場合は胃洗浄の前に短時間作用型バルビツール酸系薬剤を用量に注意し投与する。又は活性炭や下剤の投与を行う。血液循環と呼吸の維持に集中治療を行う。高熱に対しては物理的な解熱処置をとる。リタリン過量服用に対する腹膜透析、血液透析の有効性は確立していない。
その他の注意
- 1.
- **因果関係は確立していないが、本剤とクロニジンとの併用により、突然死が報告されている。クロニジン等の中枢神経系に作用するα2作動薬と併用した際のメチルフェニデートの安全性については、体系的な評価が行われていない。
- 2.
- 適応外疾患〔注意欠陥多動性障害(ADHD)〕に対する投与で、全身痙攣が報告されている。
- 3.
- メチルフェニデートの長期発癌性試験の結果、F344/Nラットを用いた試験では癌原性は認められなかった。B6C3F1マウスを用いた試験では、雌雄両性で肝細胞腺腫の増加、60mg/kg/day投与群の雄で肝芽細胞腫の発現がみられている。
- 4.
- メチルフェニデートはSalmonella typhimuriumを用いたAmes試験では突然変異誘発性は認められなかった。チャイニーズハムスターの培養卵細胞を用いた試験では姉妹染色分体変換と染色体異常の増加がみられ、弱い染色体異常誘発性が認められている。
薬物動態
- 健康成人に14C-塩酸メチルフェニデートを経口投与した研究では、血漿中14Cが最高濃度を示すのは投与後約2時間で、この14Cは主に代謝産物によるものである。投与後8、48時間での尿中排泄率はそれぞれ50、90%であり、糞中には極く少量しか排泄されない。
尿中の主要代謝産物は脱エステル化体で、投与量の80%を占めている。14Cの半減期は尿中排泄率より計算して7時間である。2)
(外国人のデータ)
臨床成績
- ナルコレプシー
- 一般臨床試験において、ナルコレプシーに対する有効率は89.6%(95/106)であった。
また、二重盲検比較試験において本剤の有用性が認められている。
薬効薬理
- 1.
中枢興奮作用
- 塩酸メチルフェニデートは大脳半球及び脳幹に高く分布することが認められており(ラット・経口投与)上位運動中枢及び知覚・感覚系に作用することが示唆されている3)が作用機序についてはいまだ明らかにされていない。
マウス、ラット、ウサギ、イヌにおいて塩酸メチルフェニデート0.5~5mg/kgの経口又は非経口的投与により運動の亢進、攻撃的行動、闘争的衝動等の中枢性興奮症状が認められている。4)
- 2.
自発運動に及ぼす影響
- マウスに塩酸メチルフェニデート15mg/kgを経口投与し、振動カゴを用いて観察した実験では投与1時間後に未処置群の4倍の運動量を示し、またラットによる回転カゴ実験において10mg/kgを経口投与した場合には著明な自発運動の亢進が認められている。4)
塩酸メチルフェニデートの運動亢進作用はその強さ及び持続性においてメタンフェタミン、カフェインのほぼ中間であることが認められている。4,5)
- 3.
睡眠に及ぼす影響6)
- REM型ナルコレプシーの患者(13例)に塩酸メチルフェニデート(10~40mg)を投与し、同じ日の午前(無投薬)と午後(試験薬投与後)の2回反復して1時間のポリグラフィを行い両記録を比較した結果、覚醒維持機能の指標となる入眠前覚醒持続時間(入眠潜時)が3.5倍に延長し強力な覚醒作用を持つことが認められている。また、REM睡眠抑制効果の指標となる入眠時REM期の持続時間の短縮が認められ、REM睡眠抑制作用の存在が示されている。
有効成分に関する理化学的知見
- 構造式
-
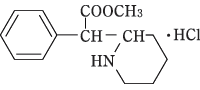
- 一般名
- 塩酸メチルフェニデート(Methylphenidate Hydrochloride)
- 化学名
- Methyl α-phenyl-2-piperidineacetate hydrochloride
- 分子式
- C14H19NO2・HCl
- 分子量
- 269.77
- 融点
- 約205℃(分解)
- 性状
- 白色の結晶性の粉末で、においはない。
水又はメタノールに溶けやすく、酢酸(100)、エタノール(95)又はクロロホルムにやや溶けやすく、ジクロロメタンにやや溶けにくく、無水酢酸又はアセトンに溶けにくく、酢酸エチルに極めて溶けにくい。
本品の水溶液(1→20)のpHは3.5~5.0である。
本品の水溶液(1→20)は旋光性がない。
承認条件
- **本剤の投与が、ナルコレプシーの診断、治療に精通し、薬物依存を含む本剤のリスク等についても十分に管理できる医師・医療機関・管理薬剤師のいる薬局のもとでのみ行われるとともに、それら薬局においては調剤前に当該医師・医療機関を確認した上で調剤がなされるよう、製造販売にあたって必要な措置を講じること。
包装
- リタリン錠「チバ」:100錠(バラ) 500錠(バラ)
- 1%リタリン散「チバ」:100g(缶)
主要文献及び文献請求先
主要文献
- 1)
- 「日本チバガイギー医薬品過量使用時の症状と処置」日本チバガイギー株式会社・医薬情報部編集、1987,P107〔RITS00072〕
- 2)
- Faraj,B.A.et al.:J.Pharmacol.Exp.Ther.191,535,1974〔RITM00869〕
- 3)
- Bernhard,K.et al.:Helv.Chim.Acta 42,802,1959〔RITI00193〕
- 4)
- Meier R.et al.:Klin.Wochenschr.32,445,1954〔RITI00084〕
- 5)
- 高木敬次郎ほか:薬学雑誌 87(7),837,1967〔RITJ00057〕
- 6)
- 高橋康郎ほか:精神薬療基金研究年報 9,201,1977〔RITJ00093〕
文献請求先
-
ノバルティス ファーマ株式会社 学術情報部
-
〒106-8618 東京都港区西麻布4-17-30
-

長期投与医薬品に関する情報
- 本剤は厚生労働省告示第107号(平成18年3月6日付)に基づき、投薬期間は1回30日間分を限度とされています。
製造販売業者等の氏名又は名称及び住所
-
製造販売
-
ノバルティス ファーマ株式会社
-
東京都港区西麻布4-17-30
-
製造
-
日本チバガイギー株式会社
-
東京都港区西麻布4-17
|



